幹細胞を用いた再生医療
再生医療の法制度
再生医療は急速に発展し、新たな治療法として期待されています。しかし、安全性や有効性を確保しなければ患者様のリスクが高まり、医療技術の健全な発展も妨げられます。
そのため、国内では「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律(薬機法)」と「再生医療等の安全性の確保等に関する法律(安確法)」により、再生医療の適切な提供が法律で定められています。
提供される項目として、保険診療下で提供される「再生医療等製品」と、自由診療下で提供される「特定細胞加工物」があり、前者は薬機法に、後者は安確法に基づいて提供されています。
TOPs細胞は安確法に定めるところの「特定細胞加工物」に該当します。
再生医療を国民が迅速かつ安全に受けられるようにするための施策の総合的な推進に関する法律

製造販売
医薬品医療機器等法
(薬機法):2014年改正
| 目的 |
|
|---|---|
| 内容 |
|
再生医療等製品
| 定義 |
|
|---|---|
| 特長 |
|

自由診療
臨床研究
再生医療等安全性確保法(安確法):2014年施行
| 目的 |
|
|---|---|
| 内容 |
|
特定細胞加工物
| 定義 |
|
|---|---|
| 特長 |
|
再生医療技術のリスク分類
安確法では下記のフローチャート図のように、人の生命及び健康に与える影響の程度に応じて「第1種再生医療等」「第2種再生医療等」「第3種再生医療等」の3つに分類されており、適切な規制を設けています。
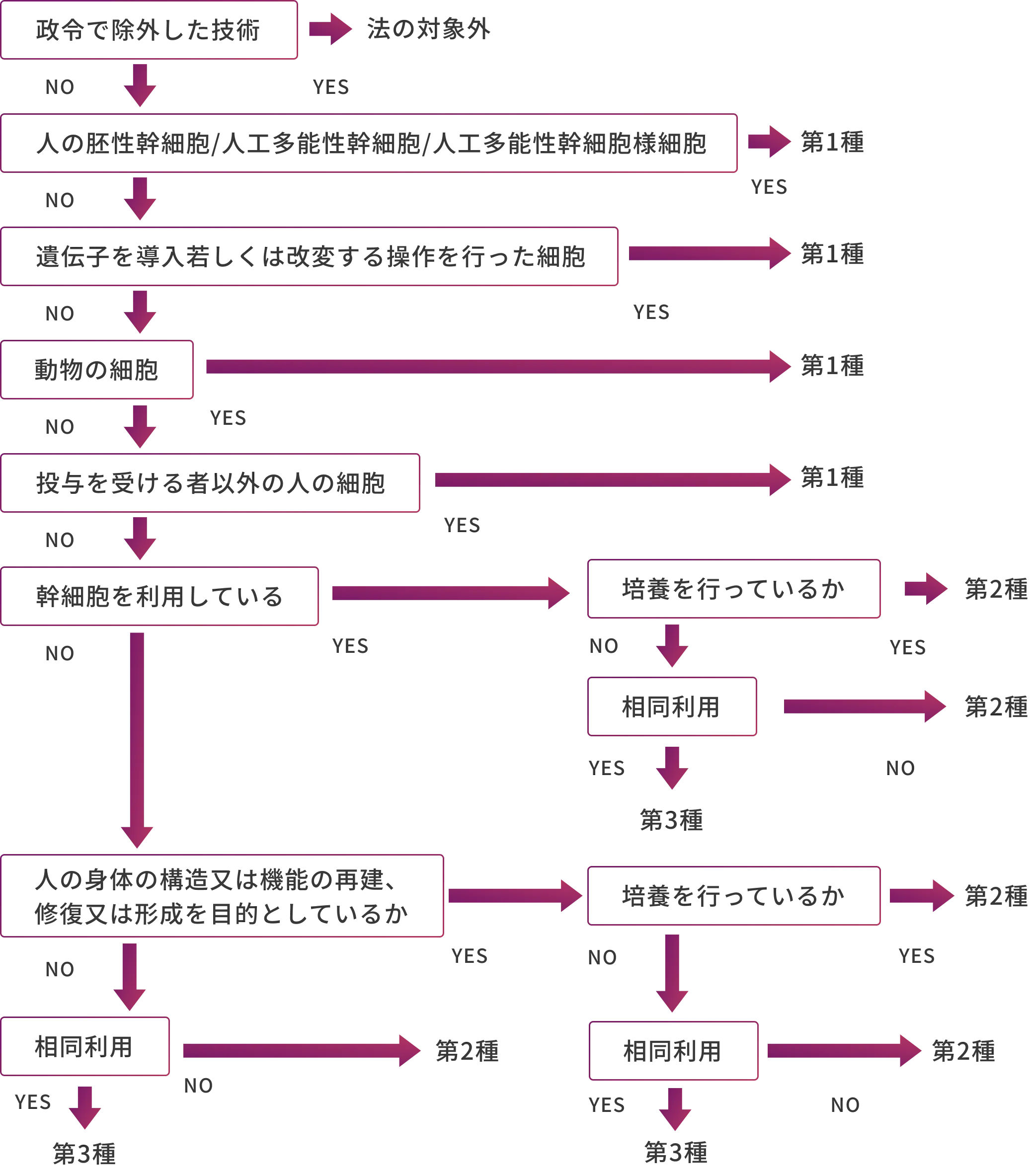
特定細胞加工物
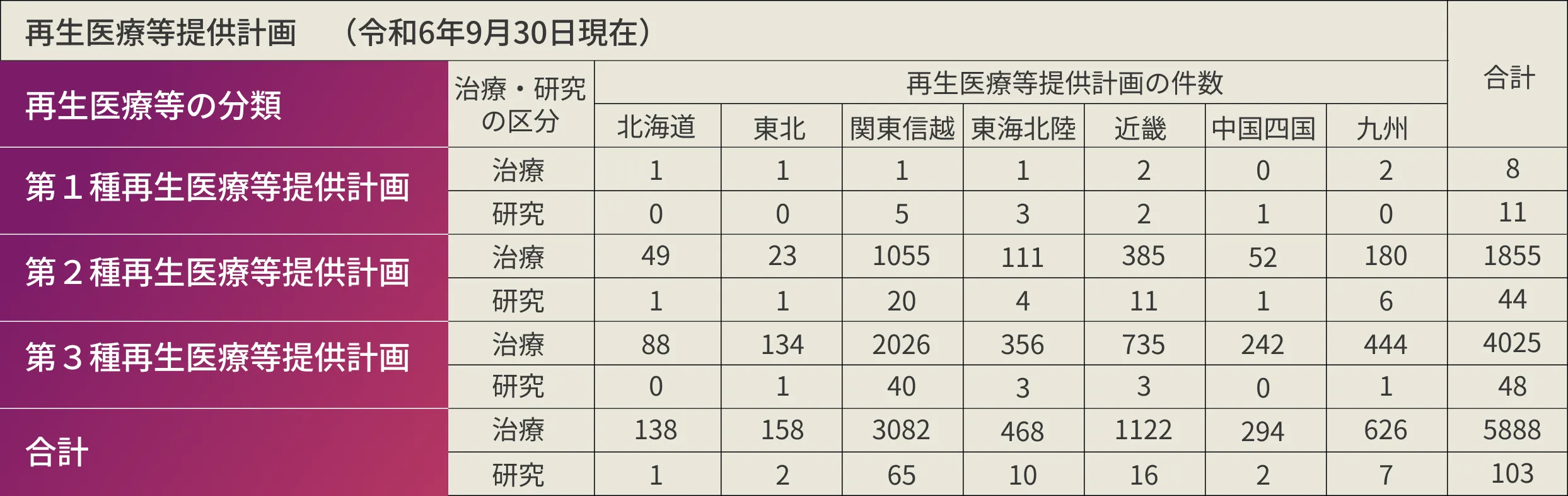
脂肪由来幹細胞は、安確法下で様々な疾患に用いられています。
脂肪由来幹細胞を用いた再生医療の多くは「第2種再生医療等提供計画」に該当しており、治療区分の約50%が脂肪由来幹細胞を用いた提供計画となっております。
主な治療対象
変形性膝関節症・関節炎
顎骨欠損・歯槽骨・歯周組織再生
靭帯・腱・筋の再生(スポーツ関連疾患)
項目
-
幹細胞治療
-
幹細胞とは
-
幹細胞を用いた再生医療
-
-
細胞
-
導入施設


